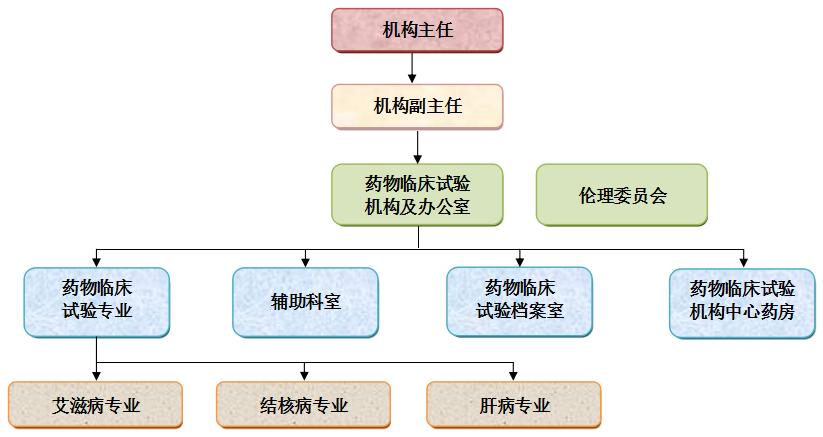
我中心于2014年1月17日成立药物临床试验机构,在行政上受中心主任直接领导。下设艾滋病专业、肝病专业、结核病专业。各专业组设有各期临床试验的专科病房、专科门诊及试验所需的配套设备以及处理不良反应所需的急救药品和抢救设备。
为保证药物临床试验高质量顺利完成,机构参照GCP原则制定了完整的管理制度和标准操作规程(SOP),使机构各项工作有“法”可依,以保证我中心药物临床研究工作的正规化和制度化。有力保障了临床试验过程的规范、专业和严谨性。
一:药物临床试验机构组织构架
二:机构人员
药物临床试验机构主任:池祥波
药物临床试验机构副主任:陈耀凯
药物临床试验机构办公室主任:欧阳净
药物临床试验机构办公室秘书:齐苗苗
质量管理员:齐苗苗、张雪
药物管理员:张雪
资料保管员:齐苗苗
三:专业组人员
结核病专业组负责人:严晓峰
结核病专业组秘书:杨伏萍
艾滋病专业组负责人:陈耀凯
艾滋病专业组秘书:刘敏
肝病专业组负责人:黄成瑜
肝病专业组秘书:华欣
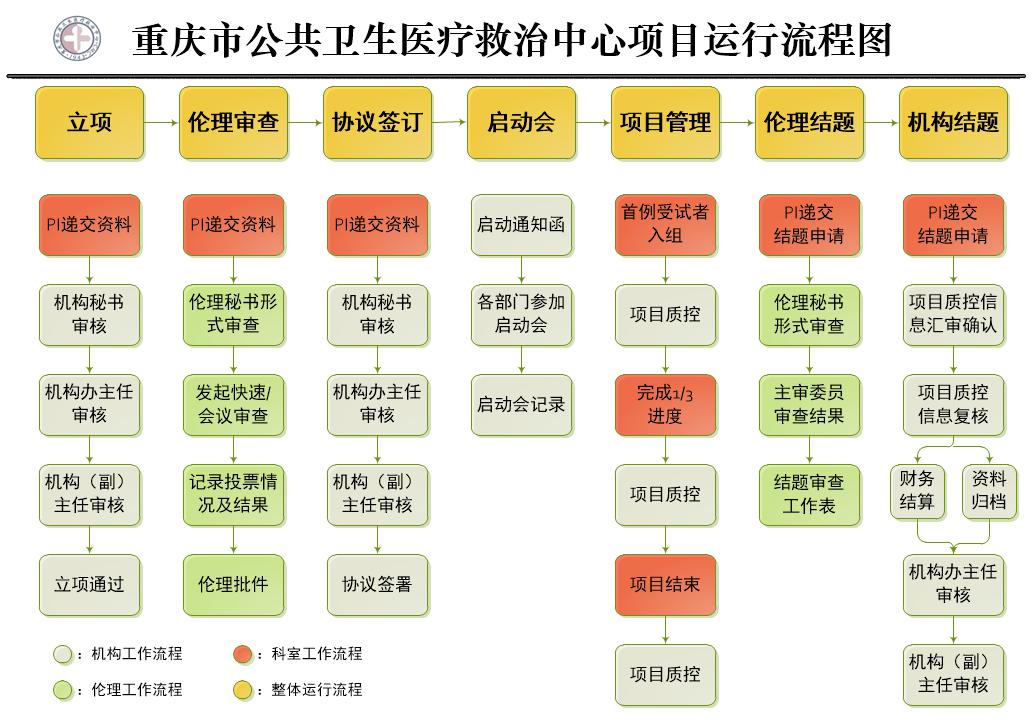
四:项目运行流程图
五:项目申请流程
1. 申办者/CRO若有意在我中心开展临床试验,请首先与本机构办公室及研究科室就相关问题进行商洽。
2. 科室若有意承接该项目,申办者/CRO可与专业负责人共同商定主要研究者(PI)。
3. 递交材料:PI按照“科室向机构办公室提交材料目录”的要求准备相关材料,签署方案签字页并填写《药物临床试验申请表》/《医疗器械临床试验申请表》,递交机构办公室秘书。经秘书清点文件齐全后,进行立项资料接收登记。机构办对送审材料进行审核。如审核通过,PI应提供“研究者履历”,交机构办审核备存。
4. 研究者会议:若本单位为组长单位,PI主持召开研究者会议,机构应派人参加该会议;若为参加单位,PI等研究人员及机构代表(若需要)参加研究者会议。
5. 伦理委员会审核:按《伦理审查申请/报告指南》进行伦理审核。最终审批意见将由伦理委员会秘书转给申请人。
6. 通过我中心伦理审批的项目,申办者/CRO与PI拟定协议和经费预算,经机构办公室审核。
六:联系方式
机构办公室电话:023-65514172
机构邮箱: gwzxgcp@163.com
七:附件
附件1. 药物临床试验申请表
附件2. 科室向机构办公室提交材料目录(药物临床试验)
附件3. 医疗器械临床试验申请表
附件4. 科室向机构办公室提交材料目录(医疗器械临床试验)
附件5. 申办者/CRO责任声明
附件6. 研究者声明样表
附件7. 研究者履历